Физический энциклопедический словарь - кристаллохимия
Кристаллохимия
326
динат атомов, расстоянии между ними, типа хим. связи; описания окружения атомов, характерных ат. группировок, тепловых колебаний атомов и т. п. По хар-ру хим. связи кристаллы делят на четыре осн. группы — ионные кристаллы (напр., NaCl), ковалентные (напр., алмаз, кремний), металлические (металлы и интерметаллич. соединения) и молекулярные кристаллы (напр., нафталин). В ионных кристаллах эл-ны переходят от атомов металлов, к-рые становятся положит.
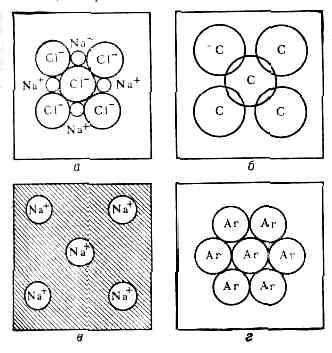
Осн. типы хим. связи в кристаллах: а — ионная связь; б — ковалентная связь; в — металлич. связь; г — связь за счёт сил Ван-дер-Ваальса.
ионами (катионами), к атомам неметаллов, к-рые становятся отрицат. ионами (анионами), что приводит к электростатич. притяжению между ними (рис., а). В случае ковалентной связи валентные эл-ны соседних атомов обобществляются, образуя «мостики» электронной плотности между связанными атомами (рис., б). В металлич. кристаллах валентные эл-ны образуют общий электронный «газ», осуществляющий коллективное вз-ствие атомов кристалла (рис., в). Расстояния между атомами для этих трёх типов связи составляют 1,5—2,5 Å. В мол. кристаллах атомы внутри молекул объединены прочными ковалентными связями, а атомы соседних молекул взаимодействуют за счёт более слабых ван-дер-ваальсовых сил, (рис., г), имеющих диполь-дипольное и дисперсионное происхождение (см. Межмолекулярное взаимодействие). Расстояние между атомами соседних молекул 3,5—4 Å. Во многих кристаллах связь имеет промежуточный хар-р, напр. в кристаллах полупроводников (Ge, GaAs) связь в осн. ковалентная, но с примесью ионной и металлической. В нек-рых кристаллах (напр., лёд, органич. кристаллы) существует т. н. водородная связь (см. Межатомное взаимодействие).
Каждому крист. в-ву присуща определ. структура, но при изменении тсрмодинамич. условий она иногда может меняться (полиморфизм). Обычно чем проще ф-ла соединения, тем более симметрична его структура. Кристаллы с одинаковой хим. ф-лой (в смысле числа и соотношения разл. атомов) могут иметь одинаковую крист. структуру (говорят, что они образуют данный «структурный тип») несмотря на различие типов связи (и з о с т р у к т у р н о с т ь): изоструктурны галогениды щелочных металлов типа NaCl и нек-рые окислы (напр., MgO), ряд сплавов (напр., Ti— Ni). Есть большие серии изоструктурных соединений с ф-лой вида АВ2, АВ3, АВХ3 и т. п. Изоструктурны кристаллы мн. элементов, напр. -Fe и Cu, образующие гранецентрированную кубич. решётку, но такую же структуру имеют и отвердевшие инертные газы. Если кристаллы изоструктурны и обладают одинаковым типом связи, то их называют изоморфными (см. Изоморфизм). Во многих случаях между изоморфными кристаллами возможно образование непрерывного ряда твёрдых растворов.
В геом. модели кристалла К. использует концепцию эфф. радиусов атомов, ионов и молекул (к р и с т а л л о х и м и ч е с к и е р а д и у сы). На основе эксперим. данных о расстояниях между атомами в кристаллах построены таблицы кристаллохим. радиусов для всех типов связей, так что межат. расстояние равно сумме радиусов (св-во аддитивности кристаллохим. радиусов). Молекулы в органич. кристаллах предстают как бы окаймлённые «шубой» ван-дер-ваальсовых радиусов.
Осн. геом. представлением в К. явл. теория плотной упаковки, к-рая наглядно объясняет расположение атомов в ряде металлич. и ионных структур. В последнем случае используется представление о заселении «пустот» в упаковке анионов катионами, имеющими меньший ионный радиус.
В мол. кристаллах структурной ед. плотной упаковки явл. молекула. К. органич. соединений рассматривает правила плотной упаковки молекул, связь симметрии молекул и симметрии кристалла, типы органич. структур. Особые кристаллохнм. закономерности выявляются в структуре полимеров, жидких кристаллов, биологических кристаллов.
Координац. число К и вид координац. многогранника характеризуют хим. связь данного атома и структуры кристалла в целом. Напр., Be (за редкими исключениями) и Ge имеют тетраэдрич. окружение (K=4), у Аl и Cr координац. многогранник — октаэдр, у Pd и Pt — квадрат (K=4). Малые координац. числа указывают на значит. роль направленной ковалентной связи, большие — на большую роль ионной или металлич. связей.
Во многих крист. структурах (графит, MoS2 и др.) сосуществуют связи разл. типов. Такие структуры наз. гетеродесмическими, в отличие от гомодесмических — с однотипной связью (алмаз, металлы,
NaCl, кристаллы инертных элементов). Для гетеродесмич. структур характерно наличие фрагментов, внутри к-рых атомы соединены более прочными (обычно ковалентнымп) связями. .Эти фрагменты могут представлять собой отд. «острова», цепи, слои, каркасы. Островные структуры типичны для мол. кристаллов. Часто в кач-ве «островов» выступают отд. молекулы и многоат. ионы (напр., SO-4, NO-3, СО-3) или ат. группировки типа РtСl6 в комплексных соединениях. Ряд кристаллов имеет цепочечное строение, типичный пример — кристаллы полимеров. Слоистую структуру имеют BN, MoS2, многие силикаты. Для нек-рых классов соединений характерно наличие устойчивых структурных группировок, сочетающихся в них по-разному. Так, в силикатах осн. структурный элемент — тетраэдрич. группировка SiO4 может выступать либо изолированной, либо образовывать пары, кольца, цепочки, слои и т. п.
Образование той или иной крист. структуры определяется общим принципом термодинамики: наиболее устойчива структура, к-рая при данном давлении и данной темп-ре Т имеет минимальную свободную энергию W= U-ST, где U — энергия связи кристалла (энергия, необходимая для разъединения кристалла на отд. атомы или молекулы) при T=0 К, S — энтропия.
Свободная энергия тем выше, чем сильнее связь в кристаллах. Она составляет 100—20 ккал/моль для кристаллов с ковалентной связью, несколько меньше у ионных и металлич. кристаллов и наиболее низка для мол. кристаллов с ван-дер-ваальсовыми связями (1—10 ккал/моль). Теоретич. определение свободной энергии и предсказание структуры пока возможны лишь для сравнительно простых случаев. Они проводятся в рамках зонной квантовой теории тв. тела. В ряде случаев достаточно точные результаты даёт использование полуэмпирич. выражений для потенц. энергии вз-ствия атомов в кристаллах с тем или иным типом связи.
• Б о к и й Г. Б., Кристаллохимия, 3 изд., ., 1971; Китайгородский А. И., Органическая кристаллохимия, М., 1955; Киттель Ч., Введение в физику твердого тела, пер. с англ., М., 1978; К р е б с Г., Основы кристаллохимии неорганических соединений, пер. с нем., М., 1971; П е н к а л я Т., Очерки кристаллохимии, пер. с польск., Л., 1974; Урусов В. С., Энергетическая кристаллохимия, М., 1975; Современная кристаллография, т. 2, М., 1979.
Б. К. Вайнштейн.

Вопрос-ответ:

Похожие слова
Самые популярные термины
1 | 1384 | |
2 | 1053 | |
3 | 995 | |
4 | 944 | |
5 | 926 | |
6 | 829 | |
7 | 803 | |
8 | 802 | |
9 | 713 | |
10 | 711 | |
11 | 691 | |
12 | 638 | |
13 | 628 | |
14 | 615 | |
15 | 533 | |
16 | 525 | |
17 | 518 | |
18 | 502 | |
19 | 484 | |
20 | 480 |









